Порядок реакції по даної речовини, показник ступеня при концентрації цієї речовини в кінетичному рівнянні реакції. згідно діючих мас закону . швидкість у простій (одностадійної) реакції між речовинами А і В типу n АА + n BB: продукти дорівнює:

де UА-швидкість витрачання реагенту А, С А та С в-концентрації реагентів А і В, k - константа швидкості реакції, n А і n в - порядок реакції по реагентів А і В соотв., п = n А + n в - загальний порядок реакції (n А і n в - приватні порядки реакції). Для гомогенної реакції порядок реакції по даної речовини є стехиометрический коефіцієнт цієї речовини в рівнянні реакції. Напр., В реакції 2NO + С12: 2NOCl порядок реакції по NO дорівнює 2, порядок реакції по Сl2 дорівнює 1, а загальний порядок реакції дорівнює 3. Для простих реакцій порядок реакції завжди ціле число (1, 2 або 3).
Для складних реакцій порядок реакції рідко збігаються з сумою стехіометричних коефіцієнтів, він може бути числом змінним, дробовим і навіть негативним. Напр., Для паралельних реакцій типу
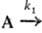 продукти;
продукти; 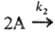 продукти (k 1 і k 2 - константи швидкості для відповідних стадій) сумарна швидкість витрачання А становить UА = k 1СА +
продукти (k 1 і k 2 - константи швидкості для відповідних стадій) сумарна швидкість витрачання А становить UА = k 1СА +  і порядок реакції змінюється в міру збільшення СА від 1 (u A - k 1 СА) до 2 (UА =
і порядок реакції змінюється в міру збільшення СА від 1 (u A - k 1 СА) до 2 (UА =  Для ланцюгової реакції типу +
Для ланцюгової реакції типу + 
 +
+ 

 D в умовах, коли k 1 CA
D в умовах, коли k 1 CA 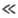
 швидкість витрачання А становить
швидкість витрачання А становить 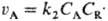 , Т. К.
, Т. К.  = (K 1 C A / k 3) 1/2, то
= (K 1 C A / k 3) 1/2, то  так що n А = 3/2. Для мономолекулярного перетворення А в присутності В, що утворює з А неактивний комплекс (А
так що n А = 3/2. Для мономолекулярного перетворення А в присутності В, що утворює з А неактивний комплекс (А  продукти; А + В
продукти; А + В  D), швидкість реакції
D), швидкість реакції  (К-константа рівноваги). Якщо рівновага зрушено вправо (C D
(К-константа рівноваги). Якщо рівновага зрушено вправо (C D 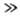 C A), порядок реакції по В дорівнює -1.
C A), порядок реакції по В дорівнює -1.
Якщо залежність швидкості витрачання вихідного реагенту або швидкості накопичення продукту складної реакції від відповідних концентрацій не описується ступеневою функцією, говорити про порядок реакції по даному реагенту (продукту) не має сенсу. Напр., Швидкість перетворення субстрату S.
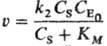
У присутності ферменту Е становить (K M-константа Міхаеліса) і залежить від початкової концентрацій ферменту  в першого ступеня, а залежність від концентрації субстрату Cs не ступеня. Така реакція має перший порядок по ферменту, говорити ж про порядок реакції по субстрату не має сенсу.
в першого ступеня, а залежність від концентрації субстрату Cs не ступеня. Така реакція має перший порядок по ферменту, говорити ж про порядок реакції по субстрату не має сенсу.
Існує ряд емпіричних методів визначення порядку реакції 1) Проводять серію дослідів зі змінною концентрацією реагенту А, визначають початкову швидкість його витрачання UА і знаходять порядок реакції як відношення: n А = d ln u A / d ln C A. 2) Всі реагенти, крім А, беруть в надлишку, швидкість витрачання A ut вимірюють в різні моменти часу t, порядок реакції знаходять як відношення: n А = d ln ut / d ln C A. 3) вимірюють час t 1 / p перетворення А на 1 / p- ю частина, коли все реагенти, крім А, взяті в надлишку. Це час не залежить від початкової концентрації 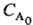 в-ва А, якщо n А = 1; воно обернено пропорційно
в-ва А, якщо n А = 1; воно обернено пропорційно 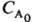 при n А = 2 і обернено пропорційно
при n А = 2 і обернено пропорційно  при n А = 3. Так, для перетворення на 50% t 1/2 = k- 1 ln 2 при n А = 1; t l / 2 = (k
при n А = 3. Так, для перетворення на 50% t 1/2 = k- 1 ln 2 при n А = 1; t l / 2 = (k  ) -1 при n А = 2 і t 1/2 = 3/2 k при n А = 3. Тут k- константа швидкості реакції, якщо
) -1 при n А = 2 і t 1/2 = 3/2 k при n А = 3. Тут k- константа швидкості реакції, якщо 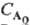 в реакції бере участь тільки один реагент А; якщо ж А реагує з В, то k дорівнює константі швидкості, помноженої на початкову концентрацію В. В загальному випадку для п - 1 t 1 / p = k -1ln [p / (p -l)], a для n .1 t 1 / р = {[p / p -1] n-1-- 1}
в реакції бере участь тільки один реагент А; якщо ж А реагує з В, то k дорівнює константі швидкості, помноженої на початкову концентрацію В. В загальному випадку для п - 1 t 1 / p = k -1ln [p / (p -l)], a для n .1 t 1 / р = {[p / p -1] n-1-- 1}  • (п - 1) k. 4) Чи стежать за витрачанням А і визначають порядок реакції по кінетичної кривої (див. Кінетичне рівняння). Якщо n А = 1, то А витрачається за експоненціальним законом і UА = e-kt. Якщо я = 2, то кінетична крива описується ф-лій:
• (п - 1) k. 4) Чи стежать за витрачанням А і визначають порядок реакції по кінетичної кривої (див. Кінетичне рівняння). Якщо n А = 1, то А витрачається за експоненціальним законом і UА = e-kt. Якщо я = 2, то кінетична крива описується ф-лій: 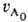 UА =
UА =  (1 + 2 k
(1 + 2 k 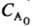 t) - 2. За збігом експериментальних даних з однієї з цих формул визначають n А.
t) - 2. За збігом експериментальних даних з однієї з цих формул визначають n А.
Якщо продукти реакції впливають на її перебіг, наприклад при автокаталізу, кинетич. рівняння стає наближеним. У цих випадках найбільш надійним є 1-й метод визначення порядку реакції. Загальний порядок реакції можна визначити будь-яким з перечисл. методів, проводячи реакцію з стехіометріч. сумішшю реагентів.
Літ. см. при ст. Кінетика хімічна. © Е. Т. Денисов.