розчини
Що таке розчин
Якщо посолити бульйон і розмішати ложкою, то не залишиться й сліду солі. Не слід думати, що крупинок солі просто не видно неозброєним оком. Кристалики солі ніяким способом не вдасться виявити з тієї причини, що вони розчинилися. Якщо надати в бульйон перцю, то розчину не вийде. Можна перемішувати бульйон хоч цілодобово - крихітні чорні крупинки не зникнуть.
Але що значить - "речовина розчинилося"? Адже атоми або молекули, з якого воно побудовано, не можуть пропасти безслідно? Звичайно, немає, вони і не пропадають. При розчиненні зникає лише крупинка речовини, кристалик, скупчення молекул одного сорту. Розчинення полягає в такому перемішуванні частинок суміші, при якому молекули однієї речовини розподіляються між молекулами іншого. Розчин - це суміш молекул або атомів різних речовин.
Розчин може містити різні кількості розчиненої речовини. Склад розчину характеризується його концентрацією, наприклад, відношенням числа грамів розчиненої речовини до числа літрів розчину.
У міру додавання речовини, що розчиняється концентрація розчину зростає, але не безмежно. Рано чи пізно розчин стає насиченим і перестає "приймати в себе" розчиняється речовина. Концентрація насиченого розчину, т. Е. "Гранична" концентрація розчину, називається розчинністю.
Дивно багато цукру можна розчинити в гарячій воді. При температурі 80 ° С повний стакан води прийме без залишку 720 г цукру. Цей насичений розчин буде густим і в'язким, кухарі називають його цукровим сиропом. Ми привели для цукру цифру для гранчака, ємність якого 0,2 л. Значить, концентрація цукру в воді при 80 ° С дорівнює 3600 г / л (читається: "грам на літр").
Розчинність деяких речовин сильно залежить від температури. При кімнатній температурі (20 ° С) розчинність цукру в воді падає до 2000 г / л. Навпаки, розчинність солі зовсім небагато змінюється зі зміною температури.
Цукор і сіль добре розчиняються у воді. А ось нафталін в воді практично не розчиняється. Різні речовини в різних розчинниках розчиняються зовсім по-різному. Повторимо ще раз, що в дуже багатьох випадках розчинами користуються для вирощування монокристалів. Якщо підвісити в насичений розчин маленький кристалик розчиненої речовини, то в міру випаровування розчинника розчинена речовина буде висаджуватися на поверхні цього кристала. При цьому молекули будуть дотримуватися строгий порядок, і в результаті маленький кристалик перетвориться на великий, залишаючись монокристалом.
Розчини рідин і газів
Чи можна розчинити рідина в рідині? Зрозуміло, можна. Наприклад, горілка - це розчин спирту у воді (або, якщо завгодно, води в спирті, - дивлячись чого більше). Горілка - справжній розчин, молекули води і спирту повністю перемішані в ній.
Однак не завжди при змішуванні двох рідин вийде такий результат.
Спробуйте підлити до води гас. Ніяким перемішуванням не вдасться отримати однорідний розчин, це так само безнадійно, як розчиняти перець в супі. Як тільки перемішування припиняється, рідини розташовуються шарами: важча вода - внизу, легший гас - нагорі. Гас з водою і спирт з водою - системи, протилежні за властивостями розчинності.
Однак є і проміжні випадки. Якщо змішати ефір з водою, то ми чітко побачимо в посудині два шари. На перший погляд може здатися, що зверху ефір, а внизу вода. Насправді ж і нижній і верхній шари є розчинами: внизу - вода, в якій розчинилася частина ефіру (концентрація 25 г ефіру на літр води), а нагорі - ефір, в якому є помітне кількість води (60 г / л).
Тепер поцікавимося розчинами газів. Ясно, що всі гази розчиняються один в одному в необмежених кількостях. Два газу завжди перемішуються так, що молекули одного проникають між молекулами іншого. Адже молекули газів мало взаємодіють один з одним, і кожен газ поводиться в присутності іншого газу, в деякому сенсі не звертаючи "уваги" на свого співмешканця.
Гази можуть розчинятися і в рідинах. Однак вже не в будь-яких кількостях, а в обмежених, не відрізняючись в цьому відношенні від твердих речовин. При цьому різні гази розчиняються по-різному, і відмінності ці можуть бути дуже великими. У воді можна розчинити велику кількість аміаку (на півсклянки холодної води - близько 100 г), великі кількості сірководню і вуглекислоти. У незначній кількості розчинні у воді кисень і азот (0,07 і 0,03 г на літр холодної води). Таким чином, в літрі холодної води знаходиться всього лише близько сотої грама повітря. Однак і це невелика кількість відіграє велику роль в житті на Землі - адже розчиненим у воді киснем повітря дихають риби.
Чим більше тиск газу, тим більше його розчиниться в рідині. Якщо кількість розчиненого газу не дуже велике, то між ним і тиском газу над поверхнею рідини є пряма пропорційність.
Хто не отримував задоволення від холодної газованої води, так добре вдовільняючою спрагу! Отримання газованої води можливо завдяки залежності кількості розчиненого газу від тиску. Вуглекислий газ заганяють в воду під тиском (з балонів, які є у кожного кіоску, де продають газовану воду). Коли воду наливають в стакан, тиск падає до атмосферного і вода виділяє "зайвий" газ у вигляді бульбашок.
З огляду на подібні ефекти, водолазів не можна швидко піднімати з води на поверхню. Під великим тиском на глибині в крові водолаза розчиняється додаткова кількість повітря. При підйомі тиск падає, повітря починає виділятися у вигляді бульбашок і може закупорити кровоносні судини.
тверді розчини
У житті слово "розчин" застосовують до рідин. Однак існують і тверді суміші, атоми або молекули яких є однорідним перемішані. Але як отримати тверді розчини? За допомогою маточки і ступки їх не отримаєш. Тому що змішуються речовини треба спочатку зробити рідкими, т. Е. Розплавити, потім змішати рідини і дати суміші затвердіти. Можна зробити й інакше - розчинити дві речовини, які ми хочемо змішати, в будь-якої рідини, а потім вже випарити розчинник. Такими способами можуть вийти тверді розчини. Можуть вийти, але зазвичай не виходять. Тверді розчини - це рідкість. Якщо в солону воду кинути шматок цукру, він чудово розчиниться. Випарується воду; на дні чашки виявляться дрібні кристалики солі і цукру. Сіль з цукром не дають твердих розчинів.
Можна розплавити в одному тиглі кадмій з вісмутом. Після охолодження ми побачимо в мікроскоп суміш кристалів кадмію і вісмуту. Вісмут і кадмій теж не утворюють твердих розчинів.
Необхідною, хоча і не достатнім, умовою виникнення твердих розчинів є близькість молекул або атомів змішуються речовин за формою і розмірами. В цьому випадку при замерзанні суміші утворюється один сорт кристаликів. Вузли решітки кожного кристала зазвичай безладно заселені атомами (молекулами) різних сортів.
Сплави металів, що мають велике технічне значення, часто являють собою тверді розчини. Розчиненням невеликої кількості домішки можна різко змінити властивості металу. Яскравою ілюстрацією цього є отримання одного з найбільш поширених в техніці матеріалів - стали, що представляє собою твердий розчин малих кількостей вуглецю - близько 0,5 вагового відсотка (один атом вуглецю на 40 атомів заліза) - в залозі, причому атоми вуглецю безладно впроваджені між атомами заліза .
У залозі розчиняється лише невелике число атомів вуглецю. Однак деякі тверді розчини утворюються при змішуванні речовин в будь-яких пропорціях. Прикладом може служити сплав золото - мідь. Кристали золота і міді мають грати однакового типу - кубічну гранецентрированную. Таку ж грати має сплав міді з золотом. Уявлення про структуру сплаву зі все збільшується часткою міді ми отримаємо, якщо будемо подумки видаляти з решітки атоми золота і замінювати їх атомами міді. При цьому заміна відбувається безладно, атоми міді розподіляються в загальному як попало по вузлах решітки. Сплави міді з золотом можна назвати розчинами заміщення, а сталь є розчином іншого типу - розчином впровадження.
У переважній же більшості випадків твердих розчинів не виникає, і, як говорилося вище, після застигання ми можемо побачити в мікроскоп, що речовина складається з суміші дрібних кристаликів обох речовин.
Як замерзають розчини
Якщо охолодити розчин будь-якої солі у воді, то виявиться, що температура замерзання знизилася. Нуль градусів пройдено, а затвердіння не відбувається. Тільки при температурі на кілька градусів нижче нуля в рідини з'являться кристалики. Це кристалики чистого льоду, в твердому льоді сіль не розчиняється.
Температура замерзання залежить від концентрації розчину. Збільшуючи концентрацію розчину, ми будемо зменшувати температуру кристалізації. Найнижчу температуру замерзання має насичений розчин. Зниження температури замерзання розчину зовсім мале: так, насичений розчин кухонної солі у воді замерзне при - 21 ° С. За допомогою інших солей можна домогтися ще більшого зниження температури; хлористий кальцій, наприклад, дозволяє довести температуру затвердіння розчину до -55 ° С.
Розглянемо тепер, як йде процес замерзання. Після того як з розчину випадуть перші кристали льоду, фортеця розчину збільшиться. Тепер відносне число чужих молекул зросте, перешкоди процесу кристалізації води також збільшаться, і температура замерзання впаде. Якщо не знижувати температуру далі, то кристалізація зупиниться.
При подальшому зниженні температури кристалики води (розчинника) продовжують виділятися. Нарешті, розчин стає насиченим. Подальше збагачення розчину розчиненим речовиною стає неможливим, і розчин застигає відразу, причому якщо розглянути в мікроскоп замерзлу суміш, то можна побачити, що вона складається з кристалів льоду і кристалів солі.
Таким чином, розчин замерзає не так, як проста рідина. Процес замерзання розтягується на великий температурний інтервал.
Що вийде, якщо посипати якусь обледеніла поверхню сіллю? Відповідь па питання добре відомий двірникам: як тільки сіль прийде в зіткнення з льодом, лід почне танути. Щоб явище мало місце, потрібно, звичайно, щоб температура замерзання насиченого розчину солі була нижча за температуру повітря. Якщо ця умова виконана, то суміш лід - сіль знаходиться в чужій області стану, а саме в області стійкого існування розчину. Тому суміш льоду з сіллю і буде перетворюватися в розчин, т. Е. Лід буде плавитися, а сіль розчинятися в утворюється воді. Зрештою або весь лід розтане, або утворюється розчин такої концентрації, температура замерзання якого дорівнює температурі середовища.
Площа дворика в 100 м2 покрита крижаною кіркою в 1 см - це вже не мало льоду, близько 1 т. Підрахуємо, скільки солі потрібно для очищення двору, якщо температура -3 ° С. Такий температурою кристалізації (танення) володіє розчин солі з концентрацією 45 г / л. Приблизно 1 л води відповідає 1 кг льоду. Значить, для танення 1 т льоду при -3 ° С потрібно 45 кг солі. Практично користуються набагато меншими кількостями, так як не досягають повного танення всього льоду.
При змішуванні льоду з сіллю лід плавиться, а сіль розчиняється у воді. Але на плавлення потрібно тепло, і лід забирає його у свого оточення. Таким чином, додавання солі до льоду призводить до зниження температури.
Ми звикли зараз купувати фабричне морозиво. Раніше морозиво готували вдома, і при цьому роль холодильника грала суміш льоду з сіллю.
кипіння розчинів
Явище кипіння розчинів має багато спільного з явищем замерзання.
Наявність розчиненого речовини ускладнює кристалізацію. З тих же самих причин розчинена речовина ускладнює і кипіння. В обох випадках чужі молекули як би борються за збереження якомога більше розведеного розчину. Іншими словами, чужі молекули стабілізують стан основної речовини (тобто сприяють її існуванню), яке може їх розчинити.
Тому чужі молекули заважають рідини кристалізуватися, а значить, знижують температуру кристалізації. Точно так же чужі молекули заважають рідини кипіти, а значить, підвищують її температуру кипіння.
Цікаво, що до певних меж концентрації (для не дуже міцних розчинів) як зниження температури кристалізації розчину, так і підвищення температури кипіння анітрохи не залежать від властивостей розчиненої речовини, а визначаються лише кількістю його молекул. Це цікава обставина використовується для визначення молекулярної маси речовини, що розчиняється. Робиться це за допомогою чудової формули (ми не можемо тут навести її), яка пов'язує зміна температури замерзання або кипіння з кількістю молекул в одиниці об'єму розчину (і з теплотою плавлення або кипіння).
Температура кипіння води підвищується рази в три менше, ніж знижується температура її замерзання. Так, морська вода, що містить приблизно 3,5% солей, має точку кипіння 100,6 ° С ,; в той час як температура її замерзання знижується на 2 ° С.
Якщо одна рідина кипить при більш високій температурі, ніж інша, то (при тій же температурі) пружність її пара менше. Значить, - пружність пари розчину менше пружності пари чистого розчинника.
Про відмінність можна судити з наступних цифр: пружність водяної пари при 20 ° С дорівнює 17,5 мм рт. ст., пружність пара насиченого розчину кухонної солі при тій же температурі - 13,2 мм рт. ст.
Пар з пружністю 15 мм рт. ст., ненасичений для води, буде перенасичений для насиченого розчину солі. У присутності такого розчину пар почне конденсуватися і переходити в розчин. Зрозуміло, забирати водяна пара з повітря буде не тільки розчин солі, але і сіль в порошку. Адже перша ж крапелька води, що випала на сіль, розчинить її і створить насичений розчин.
Всмоктування сіллю водяної пари з повітря призводить до того, що сіль стає сирою. Це добре знайоме господаркам і приносить їм прикрості. Але це явище зниження пружності пари над розчином приносить і користь: воно використовується для сушки повітря в лабораторній практиці. Повітря пропускають через хлористий кальцій, який є рекордсменом по забирання вологи з повітря. Якщо у насиченого розчину кухонної солі пружність пара 13,2 мм рт. ст., то у хлористого кальцію вона 5,6 мм рт. ст. До такого значення впаде пружність водяної пари при пропущенні його через достатню кількість хлористого кальцію (1 кг якого "вміщує" в себе приблизно 1 кг води). Це незначна вологість, і повітря може вважатися сухим.
Як очищають рідини ит домішок
Одним з найважливіших способів очищення рідин від домішок є перегонка. Рідина кип'ятять і направляють пар в холодильник. При охолодженні пар знову перетворюється в рідину, але ця рідина буде чистіше вихідної.
За допомогою перегонки легко позбутися від твердих речовин, розчинених в рідині. Молекули таких речовин практично відсутні в парі. Цим способом отримують дистильовану воду - абсолютно без смаку чисту воду, позбавлену мінеральних домішок,
Однак, використовуючи випаровування, можна позбутися і від рідких домішок і розділити суміш, що складається з двох або більше рідин. При цьому користуються тим, що дві рідини, що утворюють суміш, киплять не однаково.
Подивимося, як буде себе вести при кипінні суміш двох рідин, наприклад суміш води і етилового спирту, узятих в рівних пропорціях (50-градусна горілка).
При нормальному тиску вода закипає при 100 ° С, а спирт при 78 ° С. Суміш, про яку йде мова, закипить при проміжної температурі, рівній 81,2 ° С. Спирт кипить легше, тому пружність його пари більше, і при вихідному п'ятдесятивідсотковою складі суміші перша порція пара буде містити 80% спирту.
Отриману порцію пара можна відвести в холодильник і отримати рідина, збагачену спиртом. Далі цей процес можна повторювати. Однак ясно, що практику такий спосіб не влаштує - адже з кожною наступною перегонкою буде виходити все менше речовини. Щоб такої втрати не було, для цілей очищення застосовуються так звані ректифікаційні (т. Е. Очисні) колонки.
Ідея пристрою цього цікавого апарату полягає в наступному. Уявімо собі вертикальну колонку, в нижній частині якої знаходиться рідка суміш. До низу колонки підводиться тепло, вгорі проводиться охолодження. Пара, що утворюється при кипінні, піднімається догори і конденсується; утворилася рідина стікає вниз. При незмінному підводі тепла до низу і відведення тепла зверху в закритій колонці встановляться зустрічні потоки пари, що йде догори, і рідини, що стікає вниз.
Зупинимо свою Рамус на якомусь горизонтальному перетіні колонки. Через це перетин рідина проходить вниз, а пара піднімається, при цьому жодне з речовин, що входять до складу рідкої суміші, не затримується. Якщо мова йде про колонці, заповненій сумішшю спирту і води, то кількості спирту, що проходить вниз і вгору, так само як кількості води, що проходить вниз і вгору, дорівнюватимуть. Так як вниз йде рідина, а вгору пар, то це означає, що на будь-якій висоті колонки склад рідини і склад пара однакові.
Як тільки що було з'ясовано, рівновагу рідини і пара суміші двох речовин вимагає, навпаки, різного складу рідкої і парообразной фаз.
Тому на будь-якій висоті колонки відбувається перетворення рідини в пару і пара в рідина. При цьому конденсується висококипляча частина суміші, а з рідини в пар переходить низькокипляча складова.
Тому що йде вгору потік пара буде як би забирати з усіх висот низькокипляча складову, а стікає вниз потік рідини буде безперервно збагачуватися висококиплячих частиною. Склад суміші на кожній висоті встановиться різний: чим вище, тим більше відсоток низкокипящей складової. В ідеалі нагорі буде шар чистої низкокипящей складової, а внизу - шар чистої висококиплячих.
Тепер треба, тільки по можливості повільно, щоб не порушити змальованої ідеальної картини, відбирати речовини, низькокипляча - зверху, а висококиплячих - знизу.
Для того щоб практично здійснити поділ, або ректифікацію, треба дати можливість зустрічним потокам пара і рідини як слід перемішуватися. Для цієї мети потоки рідини і пара затримують за допомогою тарілок, розташованих одна над іншою і сполучених зливними трубками. З переповненої тарілки рідина може стікати на нижні сходинки. Пар, що йде вгору швидким потоком (0,3 - 1 м / с), проривається через тонкий шар рідини. Схема колонки показана на рис. 5.1.
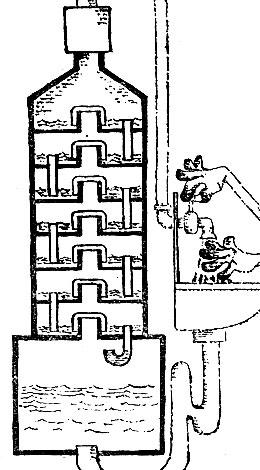
рис 5.1
Не завжди вдається очистити рідину повністю. Деякі суміші володіють "неприємним" властивістю: при певному складі суміші співвідношення компонент випаровуються молекул таке ж, що і співвідношення компонент в рідкої суміші. В цьому випадку, зрозуміло, подальша очистка описаним способом стає неможливою. Така суміш, яка містить 96% спирту і 4% води: вона дає пар такого ж складу. Тому 96% -ний спирт - найкращий, який можна отримати методом випаровування.
Ректифікація (або дистиляція) рідин є найважливішим процесом в хімічній технології. За допомогою ректифікації добувають, наприклад, бензин з нафти.
Цікаво, що ректифікація є найбільш дешевим способом отримання кисню. Для цього, зрозуміло, треба попередньо перевести повітря в рідкий стан, після чого можна ректифікацією розділити його на майже чисті азот і кисень.
Очищення твердих тіл
На склянці з хімічною речовиною, як правило, можна побачити поруч з хімічною назвою такі літери: "ч.", "Ч. Д. А." або "сп. ч.". Цими літерами умовно відзначають ступінь чистоти речовини: "ч." означає дуже невелику ступінь чистоти - в речовині ,; можливо, є домішки близько 1%; "Ч. Д. А." - речовина "чисте для аналізу" - містить не більше декількох десятих відсотка домішок; "Сп. Ч." - спектрально чиста речовина - отримати нелегко, спектральний аналіз виявляє тисячні частки домішки. Напис "сп. Ч." дозволяє сподіватися ,; що речовина по своїй чистоті характеризується принаймні "чотирма дев'ятками", т. е. що вміст основної речовини не менше 99,99%.
Потреба в чистих твердих речовинах дуже велика. Для багатьох фізичних властивостей шкідливі тисячні частки відсотка домішок, а в одній спеціальній задачі, надзвичайно цікавить сучасну тих-никуя а саме в завданню отримання напівпровідникових матеріалів, техніки вимагають чистоти в сім дев'яток.
Це означає, що рішення інженерних задач заважає один непотрібний атом на десять мільйонів потрібних! Для отримання таких надчистих матеріалів вдаються до спеціальних методів.
Надчисті германій і кремній (це і є головні представники напівпровідникових матеріалів) можна отримати повільним витягуванням зростаючого кристала з розплаву. До поверхні розплавленого кремнію (або германію) підводять стрижень, на кінці якого укріплений початковий кристал. Потім починають повільно піднімати стрижень; вилазить з розплаву кристал утворюється атомами основної речовини, атоми домішки залишаються в розплаві.
Більш широке застосування отримав метод так званої зонного плавлення. З кого очищає елементу готується пруток довільної довжини діаметром в декілька міліметрів. Уздовж прутка переміщається охоплює його маленька циліндрична піч.
Температура печі достатня для плавлення, і ділянку металу, що знаходиться всередині печі, плавиться. Таким чином, уздовж стрижня пересувається маленька зона розплавленого металу.
Атоми домішки зазвичай значно легше розчиняються в рідині, ніж у твердому тілі. Тому на кордоні розплавленої зони атоми домішки з твердих ділянок переходять в розплавлену зону і не переходять назад. Пересувається розплавлена зона як би тягне атоми домішки разом з розплавом. При зворотному ході піч вимикається і операція протягування розплавленої зони через пруток металу багаторазово повторюється. Після достатнього числа циклів залишається лише відпиляти забруднене кінець прутка. Надчисті матеріали отримують в вакуумі або в атмосфері інертного газу.
При великій частці чужих атомів очищення виробляють іншими методами, зонну плавку і витягування кристала з розплаву застосовують лише для остаточного очищення матеріалу.
адсорбція
Гази рідко розчиняються в твердих тілах, т. Е. Рідко проникають всередину кристалів. Зате існує інший спосіб поглинання газів твердими тілами. Молекули газу скупчуються на поверхні твердого тіла - це своєрідне прилипання називається адсорбцією [3] . Отже, адсорбція відбувається тоді, коли молекула не може проникнути всередину тіла, але зате успішно чіпляється за його поверхню.
Адсорбироваться - це значить поглинатися поверхнею. Але хіба може таке явище грати скільки-небудь значну роль? Адже шар товщиною в одну молекулу, нанесений на найбільший предмет, буде важити незначні частки грама.
Підрахуємо. Площа невеликий молекули - що-небудь близько 10 A2, т. Е. 10-15 см2. Значить, на 1 см2 вміститься 1015 молекул. Така кількість молекул, скажімо, води важить трохи, 3 * 10-8 м Навіть на квадратному метрі розміститься всього 0,0003 г води.
Помітні кількості речовини утворюються на поверхнях в сотні квадратних метрів. На 100 м2 доводиться вже 0,03 г води (1021 молекул).
Але хіба ми стикаємося з такими значними поверхнями в лабораторній практиці? Однак неважко збагнути, що іноді зовсім маленькі тіла, зменшуються на кінці чайної ложечки, мають величезні поверхні в сотні квадратних метрів.
Кубик зі стороною в 1 см має площу поверхні 6 см2. Разрежем кубик на 8 рівних кубиків зі стороною 0,5 см. Маленькі кубики мають межі площею 0,25 см2. Всього таких граней 6 * 8 = 48. Їх загальна площа дорівнює 12 см2. Поверхня подвоїлася.
Отже, будь-яке роздроблення тіла збільшує його поверхню. Роздрібнити тепер кубик зі стороною 1 см на частинки розміром в 1 мікрометр: 1 мкм = 10-4 см, значить, великий кубик розіб'ється на 1012 часток. Кожна частинка (для простоти припустимо, що і вона кубічна) має площу 6 мкм2, т. Е. 6 * 10-8 см2. Загальна площа частинок дорівнює 6 * 104 см2, т. Е. 6 м2. А дроблення до мікрометра зовсім не є межею.
Цілком назадній, що питома поверхня (т. Е. Поверхню одного грама речовини) може виражатися величезними цифрами. Вона швидко зростає в міру подрібнення речовини - адже поверхня зернятка зменшується пропорційно квадрату розміру, а число зерен в одиниці об'єму зростає пропорційно кубу розміру. Грам води, налитої на дно склянки, має поверхню в кілька квадратних сантиметрів. Той же грам води у вигляді дощових крапель вже матиме поверхню, вимірювану десятками квадратних сантиметрів. А один грам крапельок туману має поверхню в кілька сот квадратних метрів.
Якщо роздрібнити вугілля (чим дрібніше, тим краще), то він здатний адсорбувати аміак, вуглекислоту, багато отруйні гази. Це остання властивість забезпечило вугіллю застосування в протигазі. Вугілля дробиться особливо добре, і лінійні розміри його часток можуть бути доведені до десятка ангстрем. Тому один грам спеціального вугілля має поверхню в кілька сот квадратних метрів. Протигаз з вугіллям здатний поглинути десятки літрів газу.
Адсорбція широко використовується в хімічній промисловості. Молекули різних газів, адсорбируясь на поверхні, приходять в тісне зіткнення одна з одною і легше вступають в хімічні реакції.
Для прискорення хімічних процесів Часто використовують як вугілля, так і дрібно роздроблені метали - нікель, мідь і інші.
Речовини, що прискорюють хімічну реакцію, називаються каталізаторами.
осмос
Серед тваринних тканин є своєрідні плівки, які мають здатність пропускати через себе молекули води, залишаючись непроникними для молекул розчинених у воді речовин.
Властивості цих плівок є причиною фізичних явищ, що носять назву осмотических (або просто осмосу).
Уявіть собі, що така напівпроникна перегородка ділить на дві частини трубкуt виготовлену у формі перевернутої букви П. У одне коліно трубки наливається розчин, а в інше коліно - вода або інший розчинник. Налив в обидва коліна однакову кількість рідин, ми з подивом встановимо ,; що за однакової кількості рівнів рівноваги немає. Через короткий час рідини встановлюються на різних рівнях. При цьому підвищується рівень в тому коліні, де знаходиться розчин. Вода, відокремлена від розчину напівпроникною перегородкою, прагне розбавити розчин. Це явище і носить назву осмосу, а різниця висот називається осмотичним тиском.
У чому ж причина, що викликає осмотичний тиск? У правому коліні посудини (рис. 5.2) тиск здійснюється однією лише водою. У лівому коліні повний тиск складається з тиску води і тиску розчиненого речовини. Але повідомлення відкрито тільки для води, і рівновагу при наявності напівпроникною перегородки встановлюється не тоді, коли тиск справа одно повного тиску зліва, а тоді, коли тиск чистої води одно "водяний" частці тиску розчину. Виникає різниця повних тисків дорівнює тиску розчиненого речовини.
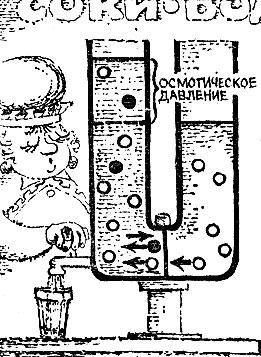
Мал. 5.2
Цей надлишок тиску і є осмотичний тиск. Як показують досліди і розрахунок, осмотичний тиск дорівнює тиску "газу", що складається з розчиненої речовини, що займає той же обсяг. Тому не дивно, що осмотичний тиск вимірюється, значними числами. Осмотичний тиск, що виникає в 1 л води при розчиненні 20 г цукру, уравновесило б стовп води висотою в 14 м.
Ризикуючи викликати в читача неприємні спогади, розберемо тепер, як -зв'язано з осмотичним тиском проносну дію розчинів деяких солей. Стінки кишечника напівпроникні для ряду розчинів. Якщо сіль через стінки кишечника не проходить (така глауберової сіль), то в кишечнику виникає осмотичний тиск, який відсмоктує воду через тканини з організму в кишечник.
Чому дуже солона вода не втамовує спраги? Виявляється, і в цьому винне осмотичнийтиск. Нирки не можуть виділяти сечу з осмотичним тиском, яке більше, ніж тиск в тканинах організму. Тому організм, який отримав солону морську воду, не тільки не віддає її тканинним рідин, але навпаки виділяє з сечею воду, відібрану у тканин.
Примітки:
3
Не слід плутати адсорбцію з абсорбцією, яка означає просто поглинання.
Але що значить - "речовина розчинилося"?
Адже атоми або молекули, з якого воно побудовано, не можуть пропасти безслідно?
Але як отримати тверді розчини?
Що вийде, якщо посипати якусь обледеніла поверхню сіллю?
Але хіба може таке явище грати скільки-небудь значну роль?
Але хіба ми стикаємося з такими значними поверхнями в лабораторній практиці?
У чому ж причина, що викликає осмотичний тиск?
Чому дуже солона вода не втамовує спраги?